Inhaltsverzeichnis
Der Major Histocompatibility Complex (MHC) ist essenziell für die Immunabwehr und die Unterscheidung zwischen körpereigenen und fremden Strukturen. Dabei handelt es sich um Proteine, die auf diversen Zellen des Körpers exprimiert werden. Der nachfolgende Artikel beleuchtet die wichtigsten genetischen Grundlagen der Komplexe, sowie deren Funktionen und ihre klinische Relevanz.
Inhaltsverzeichnis
MHC – Definition
Der Major Histocompatibility Complex (MHC), auch Haupthistokompatibilitätskomplex genannt, ist eine Gruppe von Genen und den von ihnen codierten Molekülen, die eine zentrale Rolle im Immunsystem spielen. Sie ermöglichen die Unterscheidung zwischen körpereigenen und fremden Strukturen und sind essenziell für die Initiierung spezifischer Immunreaktionen. Man bezeichnet den MHC beim Menschen auch als HLA-System (Human Leukocyte Antigen), da die MHC-Moleküle ursprünglich auf Leukozyten entdeckt wurden. Diese Moleküle präsentieren Peptide auf der Zelloberfläche, um Immunzellen das Erkennen von Krankheitserregern, Tumorzellen oder anderen Bedrohungen zu ermöglichen.
MHC – Genetische Grundlagen
Die MHC-Gene befinden sich auf Chromosom 6 (kurzer Arm) und erstrecken sich über etwa 3,5 Millionen Basenpaare. Man unterteilt diese Region in drei Klassen: Klasse I, Klasse II und Klasse III. MHC-Gene sind hochpolymorph, was eine große Vielfalt an Genvarianten (Allelen) in der Bevölkerung erzeugt. Dieser Polymorphismus ermöglicht es dem Immunsystem, auf eine breite Palette von Krankheitserregern zu reagieren und bietet auf Bevölkerungsebene einen evolutionären Vorteil bei der Anpassung an neue Bedrohungen.
Wichtige Gene für MHC-Klasse-I-Moleküle sind HLA-A, HLA-B und HLA-C, während für Klasse II HLA-DP, HLA-DQ und HLA-DR entscheidend sind. Die Klasse-III-Region enthält hingegen Gene, die für lösliche Faktoren des Immunsystems codieren, wie Komplementproteine (zum Beispiel C2 und C4) und entzündungsfördernde Zytokine wie TNF-α. Diese Komponenten tragen wesentlich zur angeborenen Immunabwehr bei.
Da jeder Mensch je ein Allel von jedem Elternteil erbt, entstehen individuelle Kombinationen. Die Co-Dominanz der MHC-Gene bedeutet, dass beide elterlichen Allele gleichwertig exprimiert werden, was die Vielfalt der präsentierten Antigene weiter erhöht. Diese Diversität ist essenziell für die Immunabwehr, stellt jedoch in der Transplantationsmedizin eine Herausforderung dar, da Unterschiede zwischen Spender und Empfänger Abstoßungsreaktionen hervorrufen können.
MHC – Struktur und Funktion
Die MHC-Moleküle sind Glykoproteine, welche die Zellen auf ihrer Oberfläche exprimieren. Sie präsentieren Peptide an T-Zellen. Dies erlaubt dem Immunsystem, gesunde Zellen von infizierten oder entarteten Zellen zu unterscheiden. Es gibt zwei Hauptklassen von MHC-Molekülen:
- MHC-Klasse-I-Moleküle:
Diese Moleküle befinden sich auf nahezu allen kernhaltigen Zellen. Sie präsentieren intrazelluläre Peptide, etwa von Viren oder mutierten Proteinen, an CD8⁺-T-Zellen. Diese erkennen infizierte oder entartete Zellen und initiieren deren Zerstörung. Auch natürliche Killerzellen (NK-Zellen) reagieren auf Zellen mit reduzierter MHC-I-Expression. Dieser sogenannte „Missing-Self“-Mechanismus ist ein zentraler Bestandteil der Überwachung auf zellulärer Ebene. - MHC-Klasse-II-Moleküle:
Nur antigenpräsentierenden Zellen wie dendritischen Zellen, Makrophagen und B-Zellen exprimiert exprimieren diese Moleküle. Sie präsentieren extrazelluläre Peptide an CD4⁺-T-Helferzellen, die die Immunantwort durch Zytokine und die Aktivierung anderer Immunzellen koordinieren.
Kreuzpräsentation
Die Kreuzpräsentation ist ein Spezialmechanismus der MHC-I-Präsentation. Hierbei können dendritische Zellen exogene Antigene aufnehmen, in das Zytosol transportieren und auf MHC-I-Molekülen präsentieren. Diese Fähigkeit ermöglicht die Aktivierung von CD8⁺-T-Zellen durch Antigene, die eigentlich extrazellulär sind. Dies ist besonders relevant bei viralen Infektionen oder Tumorimmunität.
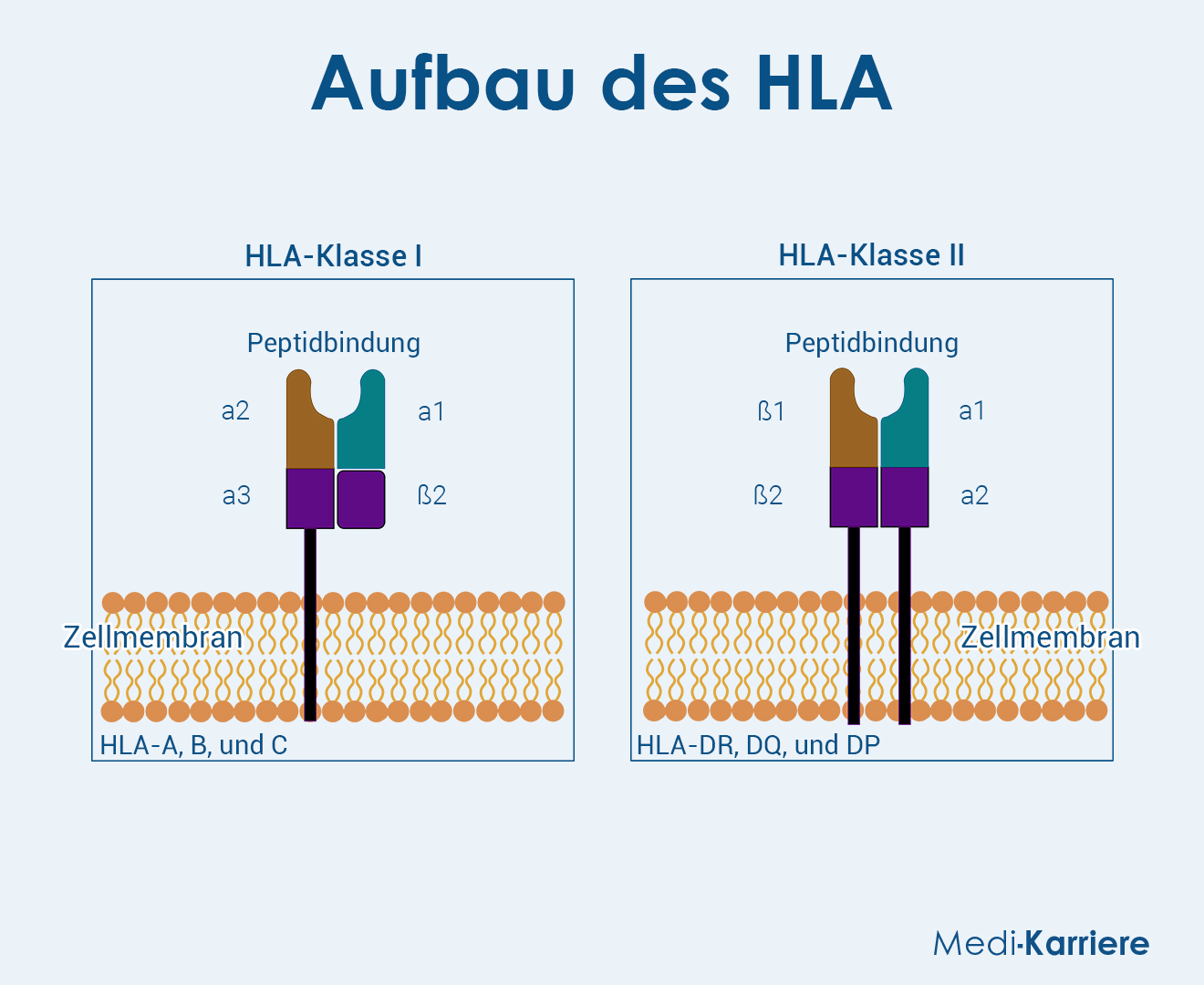
MHC – Merkmale der Klassen
Betrachtet man die Klassen im Detail, so lassen sich diverse Unterschiede feststellen, die sie voneinander abgrenzen. Gleichzeitig legen diese strukturellen Unterschiede die Grundlage für die spezifischen Funktionen, die die jeweiligen Moleküle erfüllen.
Klasse I
MHC-Klasse-I-Moleküle binden Peptide, die aus intrazellulären Proteinen stammen. Nach Abbau durch das Proteasom gelangen die Peptide über den TAP-Transporter ins endoplasmatische Retikulum, wo MHC-I-Moleküle sie aufladen. Anschließend transportiert die Zelle diese an die Zelloberfläche, wo CD8⁺-T-Zellen die Moleküle erkennen und fremde oder veränderte Peptide identifizieren.
Klasse II
Klasse-II-Moleküle binden Peptide, die aus extrazellulären Antigenen durch Phagozytose und lysosomalen Abbau entstehen. Nach Beladung der Moleküle in spezialisierten Endosomen erfolgt der Transport an die Zelloberfläche und die Erkennung durch CD4⁺-T-Zellen, welche daraufhin eine adaptive Immunantwort auslösen.
MHC – Klinische Relevanz
In der Transplantationsmedizin ist das MHC-System von zentraler Bedeutung. Eine möglichst große Übereinstimmung der HLA-Moleküle zwischen Spender und Empfänger reduziert das Risiko von Abstoßungsreaktionen. Besonders bei Stammzelltransplantationen, bei denen eine nahezu vollständige HLA-Übereinstimmung erforderlich ist, bleibt die Suche nach passenden Spendern eine Herausforderung. Dabei verwendet man häufig die sogenannte 10/10-Matching-Strategie, in deren Fokus die Prüfung der fünf wichtigsten HLA-Loci (HLA-A, -B, -C, -DR, -DQ) steht.
Bestimmte HLA-Allele sind mit einem erhöhten Risiko für Autoimmunerkrankungen wie Typ-1-Diabetes, rheumatoide Arthritis und Zöliakie assoziiert. Beispielsweise ist HLA-B27 eng mit der ankylosierenden Spondylitis (Morbus Bechterew) verbunden. Dieser Zusammenhang wird teilweise durch molekulare Mimikry erklärt, bei der Pathogenantigene strukturelle Ähnlichkeiten zu körpereigenen Peptiden aufweisen, was eine Fehlreaktion des Immunsystems auslöst.
Auch in der Krebstherapie spielt der MHC eine zentrale Rolle. Tumorassoziierte Antigene, die von MHC-I-Molekülen präsentiert werden, bilden die Grundlage für Immuntherapien wie Checkpoint-Inhibitoren und personalisierte T-Zell-Therapien. Diese Therapien nutzen die Fähigkeit des Immunsystems, MHC-präsentierte Tumorpeptide gezielt zu erkennen.
Forschung und Entwicklungen
Die Erforschung des MHC hat erhebliche Fortschritte ermöglicht, denn Massenspektrometrische Methoden erlauben die genaue Charakterisierung von Peptiden, die von MHC-Molekülen präsentiert werden. Neue Technologien wie CRISPR/Cas9 eröffnen Möglichkeiten, MHC-Moleküle gezielt zu manipulieren, etwa für die Herstellung von universellen Spenderzellen oder die Modifikation der Antigenpräsentation in Immuntherapien.
Die Kreuzpräsentation wird zunehmend als Ziel therapeutischer Ansätze genutzt, insbesondere bei der Entwicklung von Impfstoffen und Immuntherapien gegen Krebs. Impfstoffe, die auf zelluläre Immunantworten abzielen, wie mRNA-Impfstoffe, profitieren von einem besseren Verständnis der MHC-Funktion.
Die Untersuchung des MHC in der Evolution zeigt, dass die Vielfalt der MHC-Gene populationsgenetische Vorteile bietet, indem sie die Anpassung an neue Krankheitserreger erleichtert. Diese Erkenntnisse helfen, die Immunantwort auf pandemische Erreger besser zu verstehen und Strategien zur Verbesserung der öffentlichen Gesundheit zu entwickeln.
- Murphy K et. al., Janeway Immunologie (Springer, 9. Auflage, 2018)
- Unspezifisches Immunsystem, https://next.amboss.com/... , (Abrufdatum: 16.01.2025)