Inhaltsverzeichnis
Die Langerhans-Inseln, benannt nach dem deutschen Pathologen Paul Langerhans, stellen eine essenzielle Struktur innerhalb der menschlichen Bauchspeicheldrüse (Pankreas) dar. Als endokrine Einheiten sind sie von zentraler Bedeutung für die Regulierung des Kohlenhydratstoffwechsels und spielen eine Schlüsselrolle bei der Aufrechterhaltung der Glukosehomöostase. Ihre Funktion ist eng mit dem Auftreten und Verlauf von Diabetes mellitus (vor allem Typ 1) verbunden. Wie die Langerhans-Inseln mikroskopisch aufgebaut sind, wie sie genau funktionieren und was Diabetes mellitus Typ 1 ist, behandelt dieser Artikel.
Inhaltsverzeichnis
Langerhans-Inseln – Definition
Bei den Langerhans-Inseln handelt es sich um Ansammlungen von endokrinen Zellen im exokrinen Gewebe des Pankreas. Sie machen etwa ein bis zwei Prozent der gesamten Masse des Pankreas aus und sind in ihrer Funktion auf die Sekretion von Hormonen spezialisiert, die direkt in den Blutkreislauf abgegeben werden. Die Hauptaufgabe der Langerhans-Inseln besteht darin, den Blutzuckerspiegel zu regulieren und ein Gleichgewicht zwischen der Aufnahme, Speicherung und Freisetzung von Glukose herzustellen.
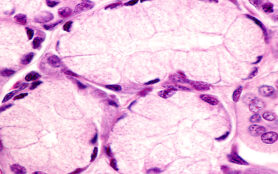
Langerhans-Inseln – Mikroskopischer Aufbau
Die Langerhans-Inseln bestehen aus mehreren Zelltypen, die durch ihre spezifischen Funktionen und sekretorischen Produkte charakterisiert werden:
- Beta-Zellen (β-Zellen): Diese Zellen machen etwa 60 bis 80 Prozent der Inselmasse aus und produzieren Insulin. Dabei handelt es sich um ein Hormon, das die Glukoseaufnahme in Zellen fördert und den Blutzuckerspiegel senkt.
- Alpha-Zellen (α-Zellen): Sie machen etwa 15 bis 20 Prozent der Inselmasse aus und sekretieren Glukagon. Dieses wirkt als Gegenspieler des Insulins, indem es die Freisetzung von Glukose aus der Leber stimuliert.
- Delta-Zellen (δ-Zellen): Diese Zellen produzieren Somatostatin, worunter man ein Hormon versteht, das die Sekretion von Insulin und Glukagon hemmt und eine regulatorische Funktion hat.
- PP-Zellen (pankreatische Polypeptid-Zellen): Sie sind für die Produktion von pankreatischem Polypeptid verantwortlich, das die exokrine und endokrine Pankreasfunktion beeinflusst.
- Epsilon-Zellen (ε-Zellen): Diese machen nur einen kleinen Anteil der Zellen aus und produzieren Ghrelin. Dabei handelt es sich um ein Hormon, das mit Hunger und Energiehomöostase in Verbindung steht.
Die Zellen der Langerhans-Inseln sind durch ein dichtes Kapillarnetzwerk miteinander verbunden, das eine effiziente Hormonfreisetzung in den Blutkreislauf gewährleistet. Zusätzlich sind sie von einer lockeren Bindegewebskapsel umgeben, die sie vom exokrinen Pankreasgewebe abgrenzt.
Langerhans-Inseln – Funktion
Die Langerhans-Inseln sind das zentrale Steuerzentrum des endokrinen Pankreas. Ihre Hauptfunktion liegt in der Regulation des Blutzuckerspiegels durch ein fein abgestimmtes Zusammenspiel von Insulin und Glukagon. Dabei wird Insulin wird von den Beta-Zellen als Reaktion auf einen erhöhten Blutzuckerspiegel nach Nahrungsaufnahme freigesetzt. Es fördert die Glukoseaufnahme in Muskel- und Fettzellen und stimuliert die Synthese von Glykogen in der Leber.
Bei niedrigem Blutzuckerspiegel wird hingegen Glukagon von den Alpha-Zellen ausgeschüttet. Es induziert die Glykogenolyse (Abbau von Glykogen) und die Glukoneogenese (Neubildung von Glukose) in der Leber, um den Blutzucker zu erhöhen. Darüber hinaus hemmt Somatostatin die Freisetzung von Insulin und Glukagon, um eine Über- oder Unterproduktion der beiden Hormone zu verhindern. Das pankreatische Polypeptid reguliert die Funktion des exokrinen Pankreas sowie die Magen-Darm-Motilität. Durch diese hormonelle Regulation tragen die Langerhans-Inseln maßgeblich zur Stabilisierung des Blutzuckerspiegels und damit zur Energiebereitstellung des Körpers bei.
Langerhans-Inseln – Diabetes mellitus Typ 1
Diabetes mellitus Typ 1 ist eine chronische Autoimmunerkrankung, die durch eine selektive und progressive Zerstörung der Insulin-produzierenden Beta-Zellen in den Langerhans-Inseln gekennzeichnet ist. Der resultierende absolute Insulinmangel führt zu einem erhöhten Blutzuckerspiegel (Hyperglykämie) und damit zu erheblichen Stoffwechselstörungen.

Pathophysiologie
Der Krankheitsprozess beginnt in der Regel mit einer genetischen Prädisposition, die durch Umweltfaktoren wie virale Infektionen (zum Beispiel Coxsackie-Viren), Nahrungskomponenten oder toxische Substanzen verstärkt wird. Diese Faktoren lösen eine Autoimmunreaktion aus, bei der autoreaktive T-Zellen die Beta-Zellen angreifen und zerstören. Begleitet wird dieser Prozess oft von der Bildung von Autoantikörpern, wie GAD65- oder IA-2-Antikörpern. Diese können als Marker für die Diagnose dienen.
Die Zerstörung der Beta-Zellen erfolgt meist schleichend. Erst wenn etwa 80 bis 90 Prozent der Beta-Zellmasse verloren gegangen ist, zeigt sich ein manifester Diabetes mellitus Typ 1 mit Symptomen wie Hyperglykämie, Polyurie und Gewichtsverlust. Ohne ausreichende Insulinproduktion können Zellen keine Glukose aufnehmen, was zu einem Energiemangel in Geweben und einer vermehrten Fett- und Proteinabbau führt. Diese Stoffwechselstörungen können in schwerwiegenden Fällen zur diabetischen Ketoazidose führen, wobei es sich um einen lebensbedrohlichen Zustand handelt.
Symptome
Die Hauptsymptome von Typ-1-Diabetes treten oft plötzlich und akut auf. Dazu gehören:
- Polydipsie: Durch den hohen Flüssigkeitsverlust verspüren die Betroffenen einen übermäßigen Durst.
- Polyurie: Aufgrund der osmotischen Wirkung der überschüssigen Glukose im Urin kommt es zu einem häufigen Wasserlassen.
- Gewichtsverlust: Dieser kommt durch den Abbau von Fett- und Muskelgewebe infolge des Energiemangels zustande.
- Müdigkeit und Schwäche: Sie entstehen als Folge der mangelhaften Energieversorgung der Zellen.
- Sehstörungen: Durch osmotische Veränderungen in der Linse kann es außerdem zu Sehstörungen kommen.
Bei unbehandeltem Typ-1-Diabetes können Symptome schnell eskalieren und zu Bewusstseinsverlust oder sogar zum Tod führen.
Diagnose
Die Diagnose von Diabetes mellitus Typ 1 erfolgt durch die Bestimmung des Blutzuckers und des Langzeitblutzuckerwertes (HbA1c). Diagnostische Kriterien umfassen einen Nüchternblutzucker von über 126 Milligramm pro Deziliter, einen Blutzuckerwert von über 200 Milligramm pro Deziliter nach einem oralen Glukosetoleranztest und ein HbA1c-Wert über 6,5 Prozent. Zur Abgrenzung von Typ-2-Diabetes können spezifische Autoantikörpertests durchgeführt werden. Eine niedrige oder nicht nachweisbare C-Peptid-Konzentration weist ebenfalls auf einen Typ-1-Diabetes hin.
Therapie
Die Behandlung von Diabetes mellitus Typ 1 erfordert eine lebenslange Insulintherapie, da die körpereigene Insulinproduktion vollständig fehlt. Moderne Ansätze umfassen Folgendes:
- Basal-Bolus-Therapie: Patienten injizieren ein langwirksames Insulin (Basalinsulin) zur Aufrechterhaltung eines stabilen Grundspiegels und ein kurzwirksames Insulin (Bolusinsulin) zu den Mahlzeiten zur Regulation der postprandialen Glukosewerte.
- Insulinpumpen: Diese Geräte liefern kontinuierlich Insulin und können individuell angepasst werden. In Kombination mit kontinuierlichen Glukosemesssystemen (CGM) ermöglichen sie eine präzise Blutzuckerkontrolle.
- Künstliche Pankreas-Systeme: Diese Technologie kombiniert Insulinpumpen und kontinuierliche Glukosemesssysteme mit Algorithmen, die die Insulinzufuhr automatisch regulieren, um den Blutzuckerspiegel möglichst stabil zu halten.
- Immunsuppressive Therapien (experimentell): Forschungen zielen darauf ab, die Autoimmunreaktion zu unterdrücken oder zu verändern. Dadurch soll der Krankheitsverlauf verzögert oder gar aufgehalten werden.
Forschung und Ausblick
Die kontinuierliche Forschung an innovativen Technologien und Behandlungsmethoden, wie Stammzelltherapien oder immunmodulatorischen Ansätzen, bietet Hoffnung auf eine langfristige Verbesserung der Lebensqualität und möglicherweise sogar auf eine Heilung. Der Schlüssel liegt in der Früherkennung und engmaschigen Überwachung, um Komplikationen zu vermeiden und die Therapie individuell anzupassen.
Langzeitkomplikationen
Ein unkontrollierter oder schlecht eingestellter Typ-1-Diabetes erhöht das Risiko für schwerwiegende Komplikationen. Dazu zählen zum einen mikrovaskuläre Komplikationen, zu denen die diabetische Retinopathie (Netzhautschäden), Nephropathie (Nierenschäden) und Neuropathie (Nervenschäden) gehören. Zum anderen können auch makrovaskuläre Komplikationen entstehen, wodurch sich ein erhöhtes Risiko für kardiovaskuläre Erkrankungen wie Herzinfarkt oder Schlaganfall ergibt. Auch das diabetische Fußsyndrom ist eine häufige Komplikation. Es zeichnet sich durch Wunden oder Geschwüre an den Füßen aus, die schlecht heilen und das Risiko für Amputationen erhöhen.
- Lüllmann-Rauch, R, Taschenlehrbuch Histologie (Thieme, 6. Auflage, 2019)
- Aumüller, G et al., Duale Reihe Anatomie (Thieme, 5. Auflage, 2020)
- Pankreas, https://next.amboss.com/... (Abrufdatum: 14.12.2024)
- Diabetes mellitus, https://next.amboss.com/... (Abrufdatum: 14.12.2024)